复杂的肿瘤微环境(TME)导致癌细胞易于转移、无限制增殖和耐药性,这导致目前的癌症治疗方法(包括手术、放疗和化疗)仍然面临不良的预后。铜死亡作为一种新发现的铜依赖性细胞死亡模式,不同于常见的细胞死亡模式,凋亡、坏死性凋亡和自噬。然而,广泛使用的铜螯合剂和铜补充剂,长期口服给药导致铜在肝脏中的积累和持续对肝细胞损伤。因此开发有效的铜死亡激活剂仍然是一个有前景但极具挑战性的研究领域。超声波(US)是一种非侵入性的机械波,具有高的组织穿透深度。US触发铜死亡活化剂可控释放表现出优良的治疗效果和广泛的生物医学应用前景。我们以Au(III)四-(4-吡啶基)卟啉(AuTPyP)为配体,铜离子(Cu2+)为节点,通过配位自组装策略,构筑了二维金属有机骨架(MOF)纳米超薄片(2DAuTPyP-Cu NSs)。通过精确调控Cu(NO3)2,苯甲酸、PVP三者的投料量,实现了二维纳米片厚度的可控。最优条件获得的超薄片厚度为3.0 nm,约5~6个分子层,具有大量的表面原子,可以为肿瘤微环境(TME)中的催化反应提供丰富的活性位点。该2D AuTPyP-Cu NSs经靶向修饰后进入肿瘤细胞,AuTPyP中吡啶基在酸性TME中质子化和深穿透超声(US)双刺激共同触发可控释放出AuTPyP和Cu2+。一方面,铁氧还蛋白1(FDX1)可将Cu2+还原为毒性更强的Cu+,并抑制Fe-S簇蛋白的生物合成。Cu2+增加二氢硫辛酰胺乙酰转移酶(DLAT)的异常聚集,并上调应激诱导的热休克蛋白(HSP70)的水平以产生蛋白质毒性应激并最终导致细胞死亡,导致明显的线粒体空泡和损伤,但不损害正常细胞;另一方面,Cu2+消耗肿瘤中过表达的谷胱甘肽(GSH),被还原为Cu+,接着发生类Fenton反应催化肿瘤中过表达的过氧化氢(H2O2)转化为活性氧。同时,释放的AuTPyP可与硫氧还蛋白还原酶特异性结合,激活肿瘤细胞的氧化还原失衡,起到化疗作用。GSH的消耗和线粒体功能损伤共同导致细胞对氧化应激和化疗药物刺激的敏感性增加,显著促进了细胞死亡。这种US/pH双刺激响应的铜死亡增强化疗显著提高了肿瘤治疗效果,为有效的肿瘤治疗提供了新的策略。
该研究成果以“Coordination self-assembled AuTPyP-Cu MOF nanosheets with pH/ultrasound dual-responsive for synergistically triggering cuproptosis-augmented chemotherapy”为题发表在ACS Nano上,河南大学博士生鲍建帅为第一作者,河南大学白锋教授、钟永副教授为共同通讯作者。(ACS Nano 2024, 18(12), 9100–9113.)
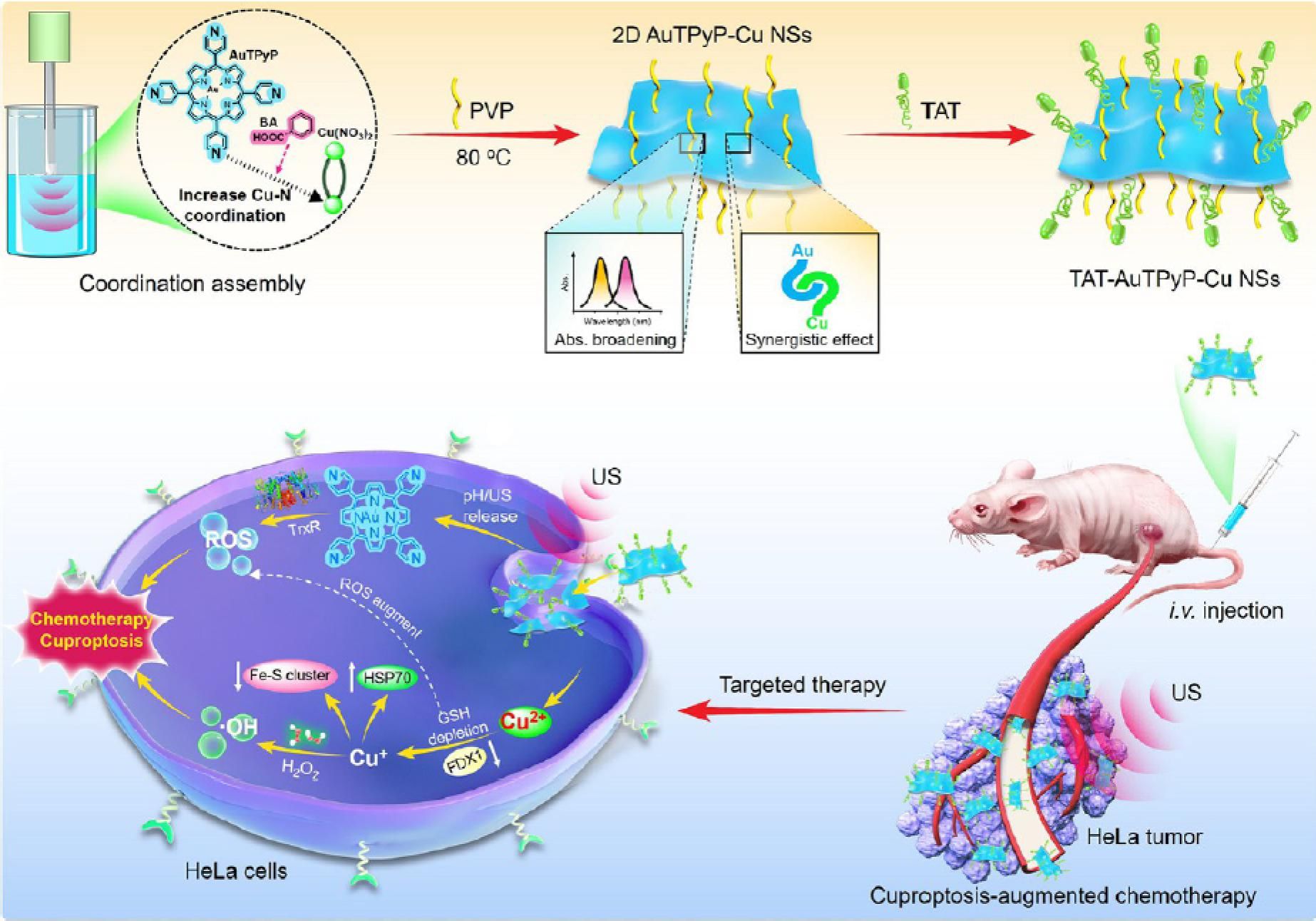
图1. 配位组装AuTPyP-Cu MOF纳米超薄片pH/超声双响应用于协同触发铜死亡增强化疗
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.3c13225
目前,研究者开发了一系列结构明确的超分子纳米光敏剂,有利推动了光敏剂的发展。然而纳米结构内部分子排列方式与光动力性能之间关系的研究则很少涉及,这对于开发高效稳定的纳米光敏剂,进而提升光动力治疗效果非常重要。针对以上问题,我们以四苯基铟卟啉(InTPP)为单体,利用微乳辅助/介相转移自组装的方式可控制备一系列铟卟啉基纳米材料,研究铟卟啉与乳化剂之间的作用方式,探究纳米材料内部结构与单线态氧生成性能的关系。研究表明,在阳离子乳化剂CTAB条件下,组装体内部卟啉分子为有序堆积方式;在阴离子乳化剂SDS条件下,SDS的阴离子端倾向于取代中心金属配位的Cl,形成无序堆积的球形组装体;两亲性乳化剂DSPE-PEG-COOH和DSPE-PEG-COONa则分别形成纳米片和纳米颗粒。在635 nm激光照射下,纳米棒生成单线态氧性能最好,其次是纳米颗粒,然后是纳米球,纳米片光动力性能最差。单晶结构解析和理论计算表明,纳米棒中铟卟啉分子沿b-c面J型堆积,相较于InTPP单分子隙间窜越加快,表现出优异的单线态氧产生能力。细胞和动物实验表明,材料具有良好的生物相容性和细胞光毒性,经过单次治疗,InTPP纳米棒能有效消除肿瘤,表现出优异的抗肿瘤性能。
该研究成果以“Microemulsion-Assisted Self-Assembly of Indium Porphyrin Photosensitizers with Enhanced Photodynamic Therapy”为题,发表在国际学术期刊ACS Nano上。河南大学硕士研究生杨林峰和博士研究生刘艳秋为本文共同第一作者,白锋教授、杨晓燕副教授和朱蕊副教授为本文共同通讯作者。(ACS Nano 2024, 18(4), 3161–3172.)
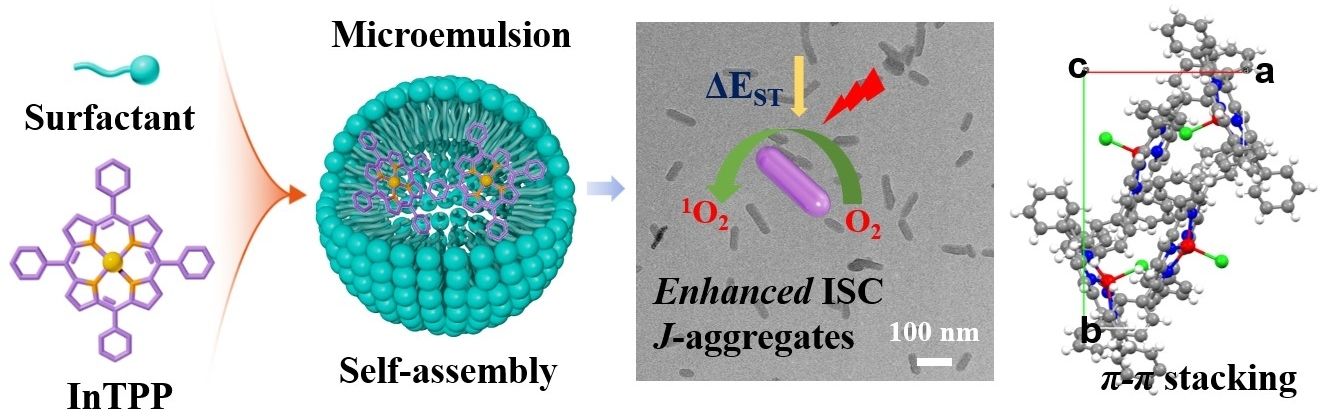
图2. FD-TENG的器件结构示意图和输出性能
论文链接:https://doi.org/10.1021/acsnano.3c09399
多形性胶质母细胞瘤(GBM)是一种最常见的恶性脑肿瘤,其较低的患者生存率主要是由血脑屏障(BBB)和高浸润性等问题所导致的。基于上转换纳米粒子(UCNPs)的深穿透近红外(NIR)光学治疗是一种很有前景的胶质瘤治疗方法,但其也存在光谱不匹配和单位点Förster共振能量转移(FRET)导致的光能利用率低等问题。我们设计了一个脑靶向的近红外诊疗系统,该系统具有双位点FRET通路和优越的光谱匹配性,可以最大限度地利用能量来实现对胶质瘤的光动力-光热协同治疗。实验对Tm掺杂的UCNPs,四苯基卟啉锌(ZnTPP)和硫化铜(CuS)纳米粒子进行多重优化调制,制备了该纳米体系。首先,研究者精确调整了Tm的掺杂比,使得UCNPs在475 nm处的相对发射强度提高了11.5倍。此外,ZnTPP的J聚集体也能够增加单体在475 nm处的吸收(163.5倍)。研究发现,两者都能够优化UCNPs和卟啉之间的FRET匹配性,以实现有效的近红外光动力治疗。同时利用800 nm处的发射来放大CuS纳米粒子的光热效应,从而通过第二种FRET途径进行光热治疗。经脑靶向肽修饰后,该系统可有效触发协同性光学治疗,消融胶质瘤细胞,并且其能够穿越血脑屏障和靶向胶质瘤,从而显著延长原位荷瘤小鼠的生存期。综上所述,该研究开发的光谱调制和双位点FRET策略有望为最大限度地利用UCNPs的光能以治疗脑部疾病提供新的借鉴和参考。
该研究成果以“Dual-Site Förster Resonance Energy Transfer Route of Upconversion Nanoparticles-Based Brain-Targeted Nanotheranostic Boosts the Near-Infrared Phototherapy of Glioma.”为题,发表在国际学术期刊ACS Nano上。河南大学生命科学学院王杰菲副教授和博士研究生上官萍为本文共同第一作者,钟永副教授、师冰洋教授和白锋教授为本文共同通讯作者。(ACS Nano, 2023, 17, 16840−16853.)
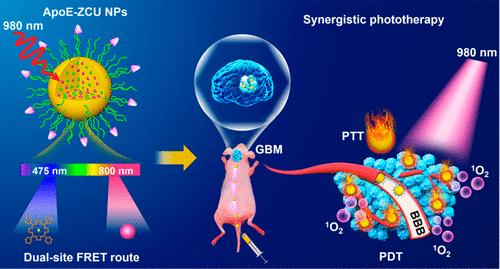
图3. 双位点Förster共振能量传递用于增强胶质瘤近红外光疗
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.3c03724
分子堆积方式不但能够影响组装体增强性能,还能够影响组装体吸收可见光后产生不同活性成分。以具有金属-N-C结构的锰酞菁(MnPc)为组装基元,通过微乳辅助的非共价键自组装策略合成了不同形貌的纳米晶。该组装方法简单有效,通过调控乳化剂的种类,实现了对组装体晶型结构和形貌的调控,实现了形貌依赖的POD-like催化性能调控。当采用十二烷基硫酸钠(SDS)为乳化剂时,快速挥发地组装过程以及SDS与MnPc分子间的相互作用增加了分子间聚集的混乱度,一定程度上限制了MnPc分子长程有序的堆积,获得了球形组装体,减少了活性位点相互掩盖,在表面暴露出更多活性位点,获得了最高的催化活性。MnPcNPs表现出高效地微环境响应性能,仅在微酸的肿瘤环境下展现出较高的催化活性,在生物医学应用中对正常组织的损伤较小。该研究为非水溶性的金属有机大分子作为纳米酶在催化肿瘤治疗中的应用开辟了新的途径。
该研究成果以“Self-assembled manganese phthalocyanine nanoparticles with enhanced peroxidase-like activity for anti-tumor therapy.”为题,发表在国际学术期刊Nano Research上。河南大学博士研究生王静菡为第一作者,加拿大滑铁卢大学刘珏文教授和河南大学白锋教授为本文共同通讯作者。(Nano Research 2022, 15(3): 2347-2354.)
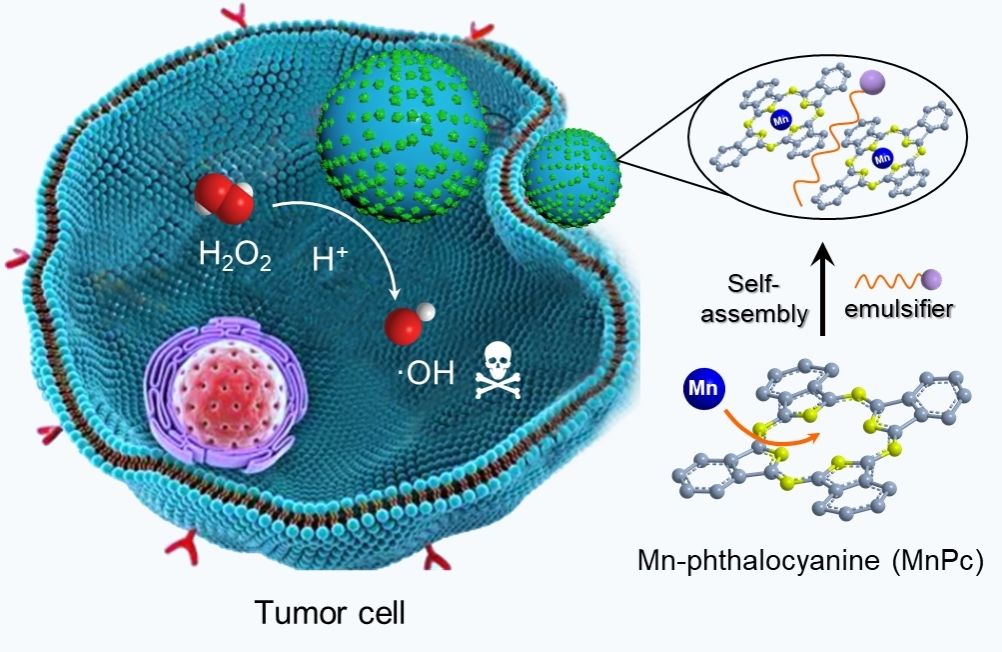
图4. MnPC组装体纳米酶催化抗肿瘤示意图
论文链接:https://link.springer.com/article/10.1007/s12274-021-3854-5
采用微乳辅助卟啉可控自组装方法,将四苯基铁卟啉(FeTPP)分子作为组装基元,引入具有良好的核磁共振成像(MRI)功能及芬顿催化性能的超顺磁性氧化铁(Fe3O4)纳米颗粒,共组装制备了粒径为102 nm的FeTPP@Fe3O4微球。Fe3O4纳米晶的引入增强了FeTPP分子的无定形聚集,增强光吸收,增加了卟啉的聚集引起的荧光淬灭(ACQ),赋予了FeTPP@Fe3O4NPS高光热性能。细胞穿膜肽(TAT)进一步靶向后得到TAT-FeTPP@Fe3O4 NPs,将其与肿瘤细胞孵育后,细胞的凋亡率为28.6%,证明肿瘤微环境响应的CDT;激光照射后,细胞的死亡率达到75.5%,证明PTT/CDT协同治疗。体外/体内MRI成像测试表明,FeTPP@Fe3O4具有良好的MRI成像功能,实现对荷瘤小鼠治疗的可视化治疗。荷瘤小鼠的治疗结果表明TAT-FeTPP@Fe3O4具有优异的PTT/CDT协同治疗效果,生物体内的器官(心,肝,脾,肺、肾)的H&E和生化分析结果表明TAT-FeTPP@Fe3O4没有系统生物毒性,进而为开发有机无机复合材料用于肿瘤靶向治疗提供重要的参考。
该研究成果以“Co-assembly of FeTPP@Fe3O4 nanoparticles with photo-enhanced catalytic activity for synergistic tumor therapy.”为题,发表在国际学术期刊Nano Research上。河南大学硕士研究生田甜和博士研究生鲍建帅为共同第一作者,河南大学白锋教授、钟永副教授为共同通讯作者。(Nano Research, 2022, 15, 9114–9124.)
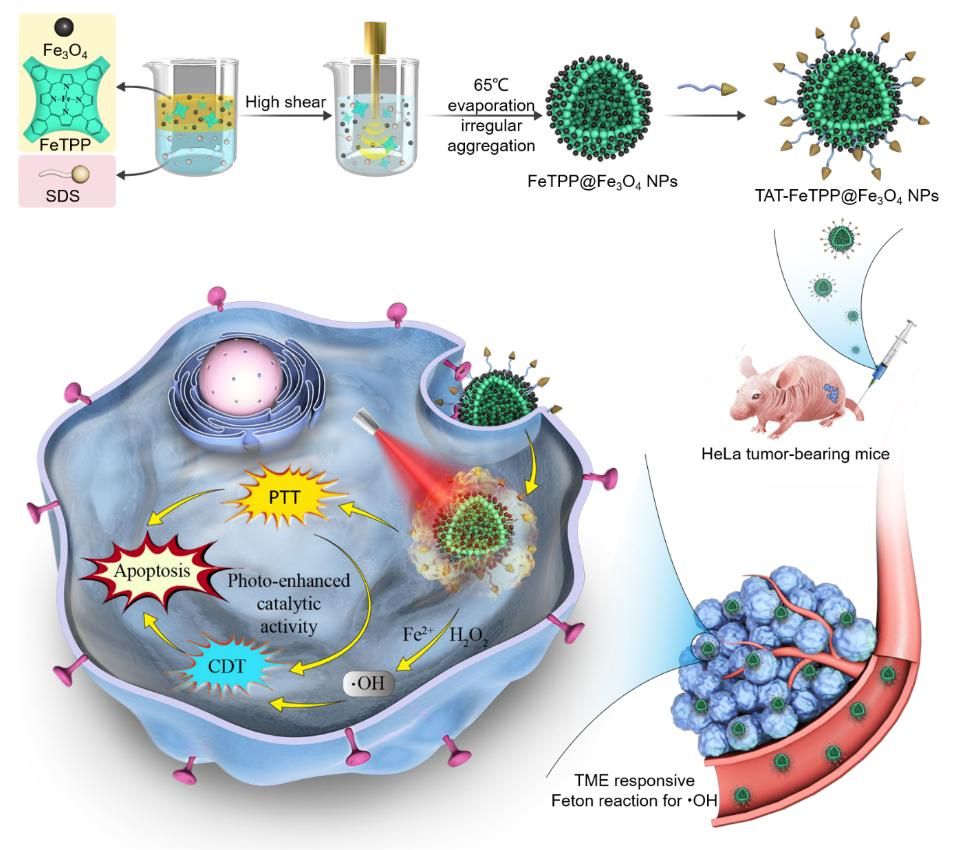
图5. FeTPP@Fe3O4-TAT复合纳米颗粒的共组装制备及其光热增强
化学动力学协同抗肿瘤治疗
论文链接:https://link.springer.com/article/10.1007/s12274-022-4548-3
上述工作得到了国家自然科学基金委、河南省高校科技创新团队支持计划和河南大学的大力支持。